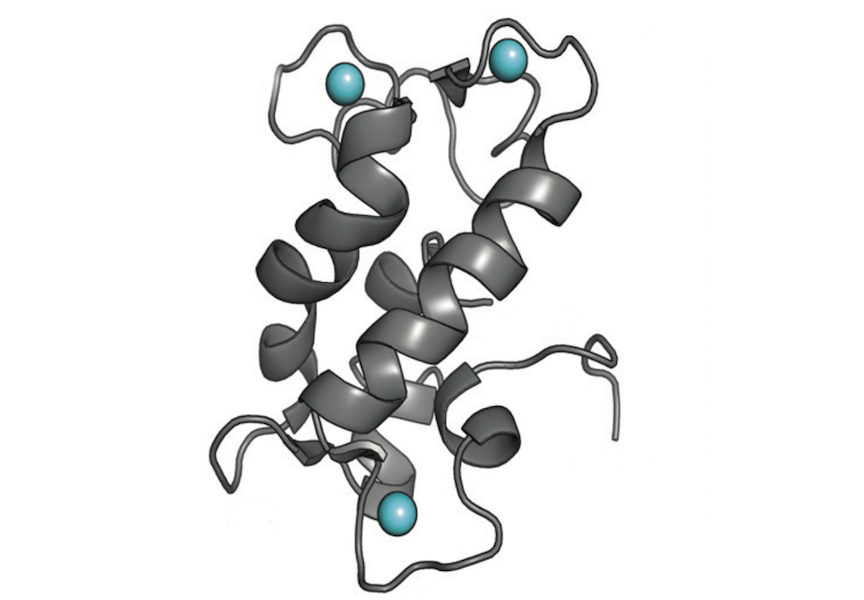
La RMN muestra la estructura de una proteína natural llamada lanmodulina, que se une a elementos de tierras raras con alta selectividad y fue descubierta hace 5 años por investigadores de Penn State. Recientemente, los investigadores reprogramaron genéticamente la proteína para preferir el manganeso a otros metales de transición comunes, como el hierro y el cobre. CRÉDITO Cotruvo Lab / Penn State
Un nuevo biosensor diseñado por investigadores de Penn State les está dando a los científicos los primeros destellos dinámicos de manganeso, un ion metálico escurridizo esencial para la vida.
Los investigadores diseñaron el sensor a partir de una proteína natural llamada lanmodulina, que se une a elementos de tierras raras con alta selectividad, y fue descubierta hace cinco años por algunos investigadores de Penn State que participan en el estudio actual.
Pudieron reprogramar genéticamente la proteína para preferir el manganeso sobre otros metales de transición comunes como el hierro y el cobre, lo que desafía las tendencias observadas con la mayoría de las moléculas de unión a metales de transición.
El sensor podría tener amplias aplicaciones en biotecnología para avanzar en la comprensión de la fotosíntesis, las interacciones huésped-patógeno y la neurociencia. También se puede aplicar de manera más general a procesos como la separación de componentes de metales de transición (manganeso, cobalto y níquel) en el reciclaje de baterías de iones de litio.
equipo recientemente publicar sus resultados En Actas de la Academia Nacional de Ciencias.
«Creemos que este es el primer sensor lo suficientemente selectivo para el manganeso como para realizar estudios detallados de este metal en sistemas biológicos», dijo Jennifer Park, estudiante de posgrado de Penn State y autora principal del artículo. «Lo usamos, y vimos la dinámica de cómo el manganeso ingresa y está presente en un sistema vivo, lo que antes no era posible».
Explicó que el equipo pudo monitorear el comportamiento del manganeso dentro de las bacterias y ahora está diseñando sensores de unión más estrecha para estudiar cómo funciona el mineral en los sistemas de los mamíferos.
El manganeso es un mineral esencial para las plantas y los animales, al igual que el hierro, el cobre y el zinc. Su función es activar enzimas, moléculas con funciones vitales dentro de los sistemas vivos. Por ejemplo, el manganeso es un componente clave de la fotosíntesis en las plantas: el manganeso se encuentra en el lugar donde el agua se convierte en oxígeno en el corazón de la fotosíntesis. En los humanos, el manganeso está relacionado con el desarrollo neurológico. Los investigadores explicaron que la acumulación excesiva de manganeso en el cerebro conduce a una enfermedad motora similar al Parkinson, mientras que se han observado niveles bajos de manganeso en la enfermedad de Huntington.
Sin embargo, la comprensión científica del manganeso se ha quedado atrás con respecto a otros minerales esenciales, en parte debido a la falta de técnicas para visualizar su concentración, localización y movimiento dentro de las células. El nuevo sensor abre la puerta a todo tipo de nuevas investigaciones, explica Joseph Cutrovo, profesor asistente de química en Penn State y autor principal del artículo.
«Hay muchas aplicaciones potenciales para este sensor», dijo Cutrovo. «Personalmente, estoy particularmente interesado en ver cómo el manganeso interactúa con los patógenos».
Explicó que el cuerpo trabaja duro para reducir el hierro que la mayoría de los patógenos bacterianos necesitan para sobrevivir, por lo que estos patógenos se convierten en manganeso.
«Sabemos que hay un tira y afloja de minerales vitales entre el sistema inmunitario y los patógenos invasores, pero no hemos podido comprender completamente esta dinámica porque no hemos podido verla en tiempo real». él dijo. , y agregó que con las nuevas capacidades para visualizar el proceso, los investigadores tienen herramientas para desarrollar nuevos objetivos farmacológicos para una variedad de infecciones que se han vuelto resistentes a los antibióticos comunes, como Staphylococcus aureus (MRSA).
Cutrovo explicó que diseñar proteínas para que se unan a metales específicos es un problema intrínseco desafiante, porque hay muchas similitudes entre los metales de transición que se encuentran en las células. Como resultado, ha habido una falta de herramientas de biología química para estudiar la fisiología del manganeso en las células vivas.
«La pregunta para nosotros era, ¿podemos diseñar una proteína para que se una a una sola cosa, un ion de manganeso, incluso en presencia de un gran exceso de otras cosas muy similares, como los iones de calcio, magnesio, hierro y zinc?» dijo Cutrovo. «Lo que teníamos que hacer era crear un sitio de unión estructurado de la manera correcta, para que este enlace proteico sea más estable en el manganeso que en cualquier otro metal».
Habiendo demostrado con éxito que lanmodulina es capaz de realizar tal tarea, el equipo ahora planea utilizarlo como un andamio con el que desarrollar otros tipos de herramientas biológicas para detectar y recuperar muchos iones metálicos diferentes que son de interés biológico y tecnológico.
«Si puedes descubrir formas de diferenciar minerales que son muy similares, eso es realmente poderoso», dijo Cutrovo. «Si podemos tomar lamodulina y convertirla en una proteína de unión a manganeso, ¿qué más podemos hacer?»
Otros coautores del artículo son Joseph Mattox y Jiansong Xu de Penn State; Michael Cleary, Huan Wang y Eric Gill del Hospital General de Massachusetts y la Facultad de Medicina de Harvard; y Danyang Lee y Somshovra Mukhopadhyay de la Universidad de Texas en Austin.
Los Institutos Nacionales de Salud y la financiación inicial de Penn State apoyaron este trabajo.
Astrobiología y Astroquímica

«Erudito en viajes incurable. Pensador. Nerd zombi certificado. Pionero de la televisión extrema. Explorador general. Webaholic».